近年來,基于核酸适體(Aptamer)構建的多價激活式診療一體化DNA納米器件在癌症診斷和治療領域受到了廣泛關注。但是,目前報道的大多數激活式多價Aptamer功能化DNA納米診療器件是通過體外組裝獲得,一方面因為尺寸較大易被網狀内皮系統清除,另一方面難以精确控制DNA納米診療器件中Aptamer修飾密度以及空間定向,而這兩個因素都會在很大程度上影響多價Aptamer功能化DNA納米診療器件的靶标結合力。近日,王柯敏/何曉曉團隊在生物醫學1區雜志《Theranostics》(2020 IF: 11.556)上發表論文,報道了一種腫瘤酸性微環境觸發的“三臂Aptamer納米爪”型(TA-aptNC)多價Aptamer功能化DNA納米器件原位組裝策略用于增強腫瘤成像對比度和高效抑制腫瘤生長研究。該策略獲得的TA-aptNC具有精确可控的表面配體修飾密度和空間定位以及尺寸大小,對提高結合能力和細胞内化效率至關重要。2003网站太阳集团博士研究生黃金是論文的第一作者。

在此項研究中,研究人員首先利用DNA納米技術構建了三種多功能DNA單體(pH-aptDMs,包括DM1I, DM2Ior DM3I),在每個單體上同時整合了刺激響應基元(裂開型i-motif探針)、靶标識别基元(Aptamer)、粘性末端組裝基元和成像、治療功能基元(Cy5/BHQ2和化療藥物Dox)。在正常生理pH條件下,三種多功能DNA單體以熒光淬滅的單分散結構存在,且具有良好的組織通透性;當處于酸性微環境中,三種被激活的多功能DNA單體通過暴露的粘性末端組裝成“三臂Aptamer納米爪”型多價Aptamer功能化DNA納米診療器件。研究人員以人肝癌細胞SMMC-7721為例,分别在細胞水平和移植瘤模型中考察了該策略的增強成像和藥物遞送效果。
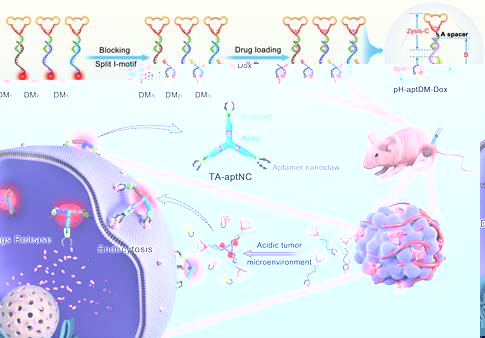
圖1.腫瘤酸性微環境激活的“三臂Aptamer納米爪”型DNA納米診療器件原位組裝策略用于增強腫瘤靶向成像和腫瘤生長抑制研究示意圖.
研究結果表明,相比于單體而言,“三臂Aptamer納米爪”型多價Aptamer功能化DNA納米器件(TA-aptNC)的靶标結合親和力提高了~2倍,識别性能和胞内藥物遞送效率也顯著增強。在移植瘤模型考察中,TA-aptNC獲得的腫瘤成像對比度分别是單價探針(pH-aptDM)和pH不敏感探針(pH-C)的1.8和3.8倍,載有Dox的TA-aptNC(TA-aptNC-Dox)活體腫瘤抑制率可達90%。在該策略中,巧妙地利用腫瘤酸性微環境驅動DNA納米結構在腫瘤位點處的組裝,實現空間選擇性的增強診療系統靶向識别能力和細胞内化能力,有望為開發時空特異性激活的精準、高效的診療一體化系統提供新思路。

圖2. “三臂Aptamer納米爪”型DNA納米診療器件的增強腫瘤靶向成像和腫瘤生長抑制效果.
參考文獻:
Huang J, Wu Y, He H, Ma W, Liu J, Cheng H, Sun H, He X*, Wang K*. Acidic microenvironment triggered in situ assembly of activatable three-arm aptamer nanoclaw for contrast-enhanced imaging and tumor growth inhibition in vivo. Theranostics 2022; 12 (7): 3474-3487.
原文鍊接:https://www.thno.org/v12p3474.htm
